
헌팅턴병 치료제 컨퍼런스 2022 – Day 2
2022 HD Therapeutics Conference #HDTC2022 2일차의 연구 업데이트를 확인하세요.
좋은 아침입니다. CHDI HD Therapeutics 컨퍼런스의 HDBuzz 보도 2일차에 오신 것을 환영합니다!
HD 치료를 위한 혁신적인 접근 방식
세 번째 HD 연구 회담의 의장은 Dr. Michael Finley(CHDI)이고 Dr. William Martin(Janssen R&D, LLC)은 HD 치료에 대한 혁신적인 접근 방식을 다룰 HD 연구 회담의 세 번째 세션 의장입니다.

첫 번째 강연은 필라델피아 어린이 병원과 펜실베니아 대학교의 Beverly L Davidson 박사가 진행하며, HD에 대한 유전자 요법 개선에 대한 그녀의 작업에 대해 논의할 것입니다.
HD에 대한 유전자 치료법 개선
데이비슨 연구실은 HD와 같은 유전 질환을 치료하기 위한 유전자 치료법을 만들기 위해 노력하고 있습니다. 그녀는 헌팅틴 유전자의 어느 부분을 표적으로 삼고 약물을 뇌에 가장 잘 전달할 수 있는지에 집중하고 있습니다. 연구원들은 가능한 한 효율적으로 이 작업을 수행하고 있는지 확인하려고 합니다. 어제 배운 것처럼 코드 시작 부분인 exon1에 작은 독성 헌팅틴 조각이 있습니다. 데이비슨 연구소는 헌팅틴 유전자의 이 부분이 개발 중인 치료법의 표적이 되도록 하는 데 중점을 두고 있습니다.
Davidson 연구실은 CRISPR로 작업하고 있습니다. 이것은 DNA 코드의 특정 문자를 편집할 수 있는 매우 정확한 도구입니다. 이 연구실은 확장된 헌팅틴 유전자를 표적으로 하기 위해 SNP(“snip”)라고 하는 고유한 유전 서명을 활용하는 것을 목표로 합니다. 이 접근 방식을 사용하여 연구자들은 확장된 헌팅틴에만 있는 SNP를 식별합니다. 이를 통해 잠재적 치료제가 유해한 헌팅틴만을 표적으로 삼고 “정상적인” 헌팅틴만 남겨둘 수 있습니다. HD의 마우스 모델에서 그들은 CRISPR 도구가 헌팅틴 단백질 수준을 약 50% 감소시키는 것으로 나타났습니다. 연구자들은 헌팅틴을 HD의 증상을 개선하기 위해 낮추어야 한다고 생각합니다.
다음으로 Davidson 연구실은 이러한 도구가 세포에 전달되는 방식을 개선하는 방법에 중점을 두었습니다. 그들은 효과적이고 안전한지 확인하기를 원합니다. Davidson 연구실은 조광기 스위치처럼 생각할 수 있는 관심 유전자의 발현 수준에 대한 정확한 조정을 허용하기 위해 깔끔한 유전적 트릭을 사용했습니다. 우리는 이전에 이 멋진 새 도구에 대해 여기에서 썼습니다: https://en.hdbuzz.net/311
이 분자 조광기 스위치는 HD 연구에 정말 강력할 수 있습니다. 헌팅틴 수준을 정밀하게 제어할 수 있고 뇌의 올바른 위치에 직접 도달하고 전달을 중단한 후 마우스의 몸을 빠르게 떠납니다. Davidson 연구실은 이제 HD 모델에 사용하기 위해 이 도구를 개선했으며 헌팅틴 수준을 미세 조정할 수 있음을 보여주었습니다. 더 많은 약물로 치료할수록 디머 스위치가 더 낮아집니다.
앞으로 그들은 이 CRISPR 도구가 전달되는 방식을 개선하고 원숭이를 포함한 다른 유형의 동물에서 테스트하는 데 집중하고 있습니다. 그들은 이 도구를 척수 주사를 통해 원숭이에게 전달했으며 매우 적은 양으로도 HD의 영향을 가장 많이 받는 영역을 포함하여 뇌의 다양한 영역에 도달한다는 것을 발견했습니다.
전반적으로 Davidson 연구실은 확장된 헌팅틴 사본만을 대상으로 하고 뇌의 많은 영역에 도달할 수 있는 흥미롭고 새로운 도구를 개발했습니다. 이것은 낮은 복용량에서도 발생하며 정밀하게 제어할 수 있습니다. 우리는 이것이 다음에 어디로 갈지 매우 기대됩니다!
RNA 표적화 CRISPR
다음은 CRISPR 기술에 대해 이야기하고 HD의 다양한 동물 모델에서 유전자 치료를 테스트하는 샌디에이고 캘리포니아 대학의 Gene Yeo입니다. Yeo 연구실은 유전 메시지인 RNA에 결합하는 단백질을 이해하는 데 중점을 두고 있습니다. 그들은 치료제를 개발하기 위해 이러한 RNA 결합 단백질을 표적으로 삼고 있습니다.
RNA 결합 단백질(RBP)은 다른 유전자의 발현을 제어할 수 있습니다. Yeo 연구실은 RBP가 결합하는 위치를 알고 싶어하며 개별 세포에서 이를 학습할 수 있는 도구를 개발했습니다. 와우!
많은 실험에서 전체 조직 또는 많은 세포에서 생성된 샘플의 변화를 살펴봅니다. 개별 세포를 살펴보면 연구자가 미묘하지만 잠재적으로 중요한 변화를 확대할 수 있습니다. Yeo 연구소의 최근 간행물은 RBP를 사용하여 특정 RNA에 결합하여 “씹어 먹게"할 수 있음을 보여주었습니다. 이것은 HD를 치료하기 위해 헌팅틴 메시지를 파괴하는 데 좋을 것입니다!
가장 최근에 그들은 CAG 반복을 특별히 표적으로 하는 RBP를 전달함으로써 헌팅틴 메시지의 감소를 보여주었습니다. 그들은 줄기 세포에서 생성된 인간 뉴런을 포함한 여러 모델에서 이를 수행할 수 있습니다. 헌팅틴 메시지의 CAG 반복이 파괴되었을 때 HD로 인한 세포의 일부 변화를 되돌릴 수 있었습니다! 그들이 주목한 한 가지 변화는 뇌 세포 건강과 관련된 유전자의 발현이 정상으로 돌아왔다는 것입니다. 그러나 그들은 쥐에게 이 치료법을 사용할 때 어떤 일이 일어나는지 알고 싶었습니다. 멋진 도구로 CAG 반복을 파괴하면 HD 쥐가 더 좋아질까요?
예! 마우스는 성능 테스트에서 더 나은 결과를 보였고 헌팅틴 단백질 덩어리가 감소했으며 MRI에서 볼 수 있는 뇌 구조가 개선되었습니다. 또한 중요한 것은 이 유전적 접근이 다른 유전자에 영향을 미치지 않는 것 같다는 것입니다. 이 멋진 새 도구는 여전히 약간의 검증이 필요하지만 HD에 대해 가장 흥미롭게도 많은 질병에 대한 약속이 많습니다!
SHIELD HD – 임상 및 바이오마커 개발 지원!
다음 연사는 Dr. Triplet Therapeutics의 Irina Antonijevic & Peter Bialek. 그들은 임상적 차이를 찾고 바이오마커를 식별하기 위해 HD 환자를 추적한 연구인 SHIELD HD 시험에 대해 논의할 것입니다.
Triplet은 체세포 불안정성으로 알려진 과정인 시간이 지남에 따라 뇌 세포에서 CAG 반복의 확장을 방지하기 위한 치료법을 연구하고 있습니다. 이것은 HD 환자의 증상 발병의 중요한 동인일 수 있습니다. 연구원들은 HD를 가진 개인의 모든 유전 정보에서 얻은 데이터를 살펴봄으로써 HD 환자가 HD로 발전하는 연령을 수정하는 체세포 불안정성을 제어하는 유전자의 변화를 확인했습니다. 그 유전자 중 하나는 MSH3이라고 합니다. Triplet은 MSH3를 표적으로 하는 치료법을 개발하고 있지만 환자를 가장 잘 치료할 수 있는 시기와 MSH3 표적 치료법으로 어떤 환자가 가장 큰 이점을 얻을 수 있는지 더 잘 이해하고 싶어합니다.
CAG 반복 확장이 HD 증상과 어떻게 관련되는지 더 잘 이해하려면 시간이 지남에 따라 사람들을 추적해야 합니다. SHIELD-HD는 자연사 연구로 알려져 있습니다. 약물을 포함하지 않지만 매우 초기 증상이 있는 HD 유전자를 가진 사람들을 모니터링합니다.
그들은 2년 이상 HD 환자를 추적했고 혈액과 CSF를 포함한 다양한 샘플을 채취했습니다. 그들은 또한 MRI 스캔을 사용하여 환자의 뇌를 분석했습니다. 그들은 SHIELD-HD 연구의 48주 기간 동안 미상과 심실이라고 하는 뇌의 다른 영역이 시간이 지남에 따라 크기가 변경되었음을 발견했습니다. 이는 HD 환자의 증상이 진행됨에 따라 예상되는 것과 같습니다.
이 연구는 또한 총 운동 점수라고 하는 또 다른 측정을 통해 시험에 참여한 사람들의 시간 경과에 따른 변화를 확인했습니다. 예상대로 시간이 지남에 따라 감소했으며 HD의 후기 단계에 있는 환자의 경우 더욱 감소했습니다. 이러한 변화는 HD 환자에게 예상되는 반면 SHIELD-HD 시험은 연구자들에게 HD 경과에 대해 더 잘 예측하는 데 사용할 수 있는 포괄적인 데이터 세트를 제공합니다. 이러한 유형의 데이터 세트는 질병 기간 동안 환자의 위치를 기반으로 환자에게 적합한 유형의 임상 시험을 신속하게 찾는 데 도움이 될 수 있습니다.
다음으로 Triplet은 MSH3 유전자를 표적으로 하는 약물에 대한 업데이트를 공유할 것입니다. 그들은 MSH3 수치를 줄이는 것이 CAG 반복에 어떻게 영향을 미치는지 알아보기 위해 원숭이를 대상으로 실험을 했습니다. 원숭이에서 MSH3를 50% 낮추어 체세포 확장이 중단되었음을 발견했습니다! 이것이 HD 환자로 해석되면 환자가 증상을 나타내기 시작하는 연령을 상당히 지연시킬 수 있습니다.
Triplet은 또한 HD 질병 진행과 치료가 얼마나 잘 작동하는지 추적하기 위해 MSH3 수준을 측정하는 데 관심이 있습니다. 그러나 그들은 뇌 조직에서 이 유전자를 검출하기 어렵기 때문에 난관에 봉착했습니다. 이 문제를 해결하기 위해 Triplet의 팀은 SHIELD-HD 시험에 참여한 HD 환자의 척수액에서 MSH3의 발현을 조사했습니다. 그들은 매우 민감한 기술을 개발해야 했습니다. 그들은 원숭이의 척수액과 뇌에서 샘플을 수집하는 다양한 방법과 TTX-3360이라는 개발 중인 약물을 테스트하는 다양한 방법을 계속 실험하고 있습니다.
그들은 다양한 질병 단계에 있는 환자의 CSF에서 MSH3의 수준을 조사했습니다. 그들은 HD가 없는 개인과 증상이 없거나 질병 초기에 HD를 가진 사람들 사이에서 이러한 수준의 차이를 발견하지 못했습니다. 이 발견은 Triplet의 연구원들이 TTX-3360을 임상 1상 시험으로 옮길 때 따라야 할 MSH3의 기준선 판독값을 제공하고 MSH3 수준이 치료에 따라 어떻게 변하는지 확인하기 때문에 중요합니다. SHIELD-HD와 같은 관찰 실험은 시간이 지남에 따라 HD 환자로부터 많은 귀중한 데이터를 수집할 뿐만 아니라 연구자가 오늘날 Triplet이 설명한 것과 같은 잠재적인 새로운 치료법을 개발할 수 있도록 합니다. 멋진 것!
휴식 시간! 오늘 아침 프레젠테이션의 나머지 부분을 위해 곧 돌아올 것입니다. 계속 지켜봐 주세요!
새로운 생물학적 통찰력
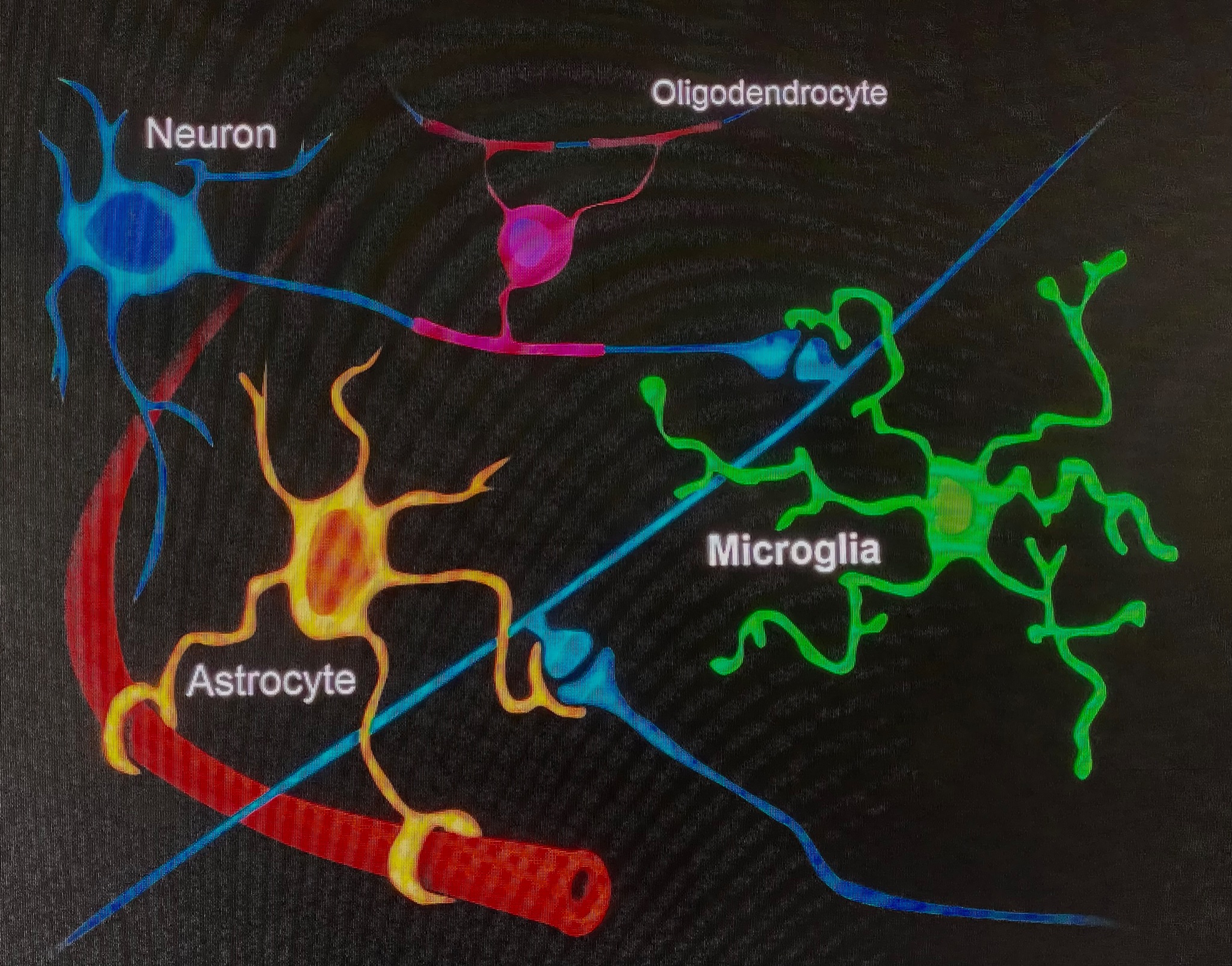
다음은 Boston Children’s Hospital과 Broad Institute의 Dr. Beth Stevens입니다. 그녀는 치료를 클리닉으로 옮기는 데 통찰력을 제공할 수 있는 그녀의 연구에 대해 이야기할 것입니다. Stevens 박사는 뇌의 면역 체계로 작용하여 침입자로부터 뇌를 보호하고 손상된 뇌 세포에서 남은 파편을 청소하는 데 도움이 되는 미세아교세포라고 하는 또 다른 특수 뇌 세포를 연구합니다.
소교세포는 매우 작으며(따라서 "마이크로”), 뇌 세포의 약 10%만 구성합니다. 그러나 피해를 입거나 박테리아가 침입하면 활성화되어 엉망진창을 청소하는 일에 착수합니다. 이러한 주요 조력 세포의 활성화는 일반적으로 뇌에 좋은 것이지만 HD를 비롯한 다양한 질병에서 세포가 너무 활동적일 수 있다고 오랫동안 생각되어 왔습니다.
스티븐스는 건강과 질병에서 미세아교세포의 역할에 대한 세계적인 전문가입니다. Stevens는 뇌에서 미세아교세포의 역할 중 하나가 시냅스를 먹는 것이라고 밝혔습니다. 시냅스는 뉴런이라고 하는 통신하는 뇌 세포 사이의 전구 모양 연결입니다. 시냅스는 좋지만 뇌에 새로운 정보를 인코딩하려면 지워야 합니다.

소교세포에게 주어진 시냅스 또는 세포를 먹거나 먹지 말라고 지시하는 “보체 시스템"이라고 하는 세포 간 통신 시스템이 있습니다. 몇 년 전, Stevens의 팀은 이 보체 시스템이 어떤 뇌 조각이 소화되어야 하는지를 결정하기 위해 소교세포에 의해 뇌에서 사용된다는 것을 발견했습니다. HD를 포함한 많은 뇌 질환에서 이 보체 시스템이 과도하게 활성화되어 보체 시스템에 대한 "나를 먹지 마세요” 신호로 명확하게 표시된 부분을 먹습니다. 팀은 보체 시스템이 HD에서 발생하는 것으로 알려진 시냅스 손실에 중요한 역할을 하는지 여부를 이해하는 데 관심이 있습니다.
그들은 HD의 영향을 받는 뇌 영역에서 특정 시냅스 집단을 식별하기 위해 매우 정교한 현미경 기법을 개발했습니다. HD 마우스에는 노화 동안 악화되는 매우 특정한 시냅스 손실 패턴이 있습니다. HD 환자의 뇌에서도 비슷한 변화가 나타납니다. 다른 질병에서 보았듯이 이 취약한 시냅스는 보체 시스템에 대한 “나를 먹어라” 신호로 장식되었습니다. 이는 HD 마우스와 환자의 미세아교세포가 뇌에서 이러한 중요한 시냅스를 제거하여 잠재적으로 질병 진행에 기여할 수 있음을 시사합니다.
HD 환자가 기증한 뇌에서 Stevens의 팀은 화난, 활성화된, 소교세포의 명백한 증거를 발견했습니다. 그런 다음 그들은 이 시스템이 질병 진행에서 어떤 역할을 하는지 보기 위해 이 시스템을 조작할 수 있는 쥐로 돌아갔습니다. Annexon Biosciences라는 회사는 보체 활성화를 차단하는 약물을 개발했습니다. 이를 통해 우리는 이 과잉 활동적인 “나를 먹어라” 활동을 차단하는 것이 HD 모델 마우스에서 HD와 유사한 증상의 발달에 기여하는지 여부를 묻습니다. 이 약물로 HD 쥐를 치료하면 원래 해야 할 일을 했습니다. “나를 먹어라"라는 레이블이 중요한 뇌 영역에 표시되는 것을 줄였습니다. 이를 통해 HD와 같은 질병에서 이러한 시냅스 제거가 좋은지 나쁜지 여부를 알 수 있습니다. 보체 시스템을 완전히 차단하기 위해 생쥐에 유전적 변화를 주는 또 다른 접근법을 사용하여 팀은 보체 활성화와 증상 사이의 관계를 연구하고 있습니다. 흥미롭게도 그들은 HD 모델 마우스에서 일부 HD 유사 증상으로부터 보호되는 것을 보았습니다.
그러나 HD 환자의 경우 실제 환자의 뇌에서도 유사한 일이 발생합니까? 팀은 Clarity를 사용하여 HD 환자의 뇌척수액에 접근할 수 있었습니다. 뇌를 목욕시키는 이 유체는 뇌 단백질을 샘플링하는 비침습적 방법이 될 수 있습니다. 그들의 예측과 일치하게, HD 환자의 척수액에서 보체 시스템의 활성화 증가에 대한 분명한 징후가 있었습니다. HD 환자에 대한 소규모 인간 연구는 현재 Annexon에서 수행되고 있습니다.
겉보기에 아주 기본적인 생물학적 연구가 HD 환자의 시험으로 어떻게 신속하게 번역될 수 있는지 확인하는 것은 매우 멋진 일입니다!
줄기 세포 연구!
다음은 UC Irvine의 Dr. Leslie Thompson입니다. Thompson은 HD를 이해하고 치료하기 위해 줄기 세포를 사용하는 분야의 오랜 리더였습니다. 줄기 세포는 HD에 취약한 뇌 세포를 포함하여 신체의 다른 세포 유형이 되도록 유도할 수 있는 매우 특별한 세포입니다.
역사적으로 이 세포는 인간 배아에서 분리해야 했지만 최근 연구자들은 성인 인간의 일반 세포를 줄기 세포로 유도하는 방법을 배웠습니다. 이러한 "유도 만능 줄기 세포"는 놀라운 도구로 연구자들이 실험실에서 실제 뇌 세포를 생성할 수 있도록 합니다.
Thompson 박사는 HD용 줄기 세포(SC4HD)라고 하는 대규모 컨소시엄을 대표하여 HD에 대한 잠재적인 세포 대체 치료법을 개발하기 위한 노력을 조정하고 있습니다. 그들은 HD를 가진 사람들에 대한 이식 연구를 위한 잠재적인 소스로서 줄기 세포주를 개발하기 위해 거대한 연구를 수행했습니다. 세포는 복잡하다! 그 팀은 아주 잘 규명된 기증자 세포 소스를 만들기 위해 엄청난 양의 표준화를 수행했습니다. 그들은 HD 마우스 모델의 실험에서 이러한 인간 줄기 세포주를 사용하여 세포를 뇌에 이식하면 마우스의 HD 유사 증상이 개선되는지 확인합니다. 흥미롭게도, 인간 줄기 세포의 이식은 상당한 개선을 이끕니다. 이것은 줄기 세포를 이식하면 생쥐의 HD 관련 증상이 일부 개선될 수 있음을 보여주는 개념 증명입니다. 이러한 개선의 토대를 이해하면 팀이 HD 환자의 증상을 예측할 수 있습니다.
장기 마우스 연구는 인간 줄기 세포 이식으로 치료된 HD 마우스 모델의 운동 증상에서 상당히 현저한 개선을 보여줍니다. 흥미롭게도 팀은 이식된 세포의 생존을 늘리기 위해 절차를 개선할 수 있었습니다.
Thompson은 인간 실험에 대한 규제 기관의 모든 요구 사항을 충족하기 위한 컨소시엄의 임상 연구를 간략하게 설명합니다. 줄기 세포에 대한 분명한 우려는 줄기 세포가 예상치 못한 세포 유형으로 자라거나 종양을 유발하지 않도록 하는 것입니다. HD 뇌의 올바른 위치에 줄기 세포를 이식하는 데 필요한 외과적 접근 방식을 테스트하는 것을 포함하여 이러한 활성화 연구가 진행 중입니다. 우리는 잘못된 부위에 이식하는 것을 원하지 않습니다!
이것으로 HD에 대한 새로운 치료법에 초점을 맞춘 흥미진진한 일련의 강연을 마치겠습니다. 오늘 오후에는 워싱턴 대학교의 데이비드 베이커(David Baker) 강연자가 있습니다. 우리는 그 이야기를 트윗하지 않을 것이므로 내일 더 흥미로운 업데이트를 기대하십시오!


