
헌팅턴병의 지역별 퇴행에 대한 새로운 연구
헌팅턴병에서 특정 뇌세포가 죽는 이유는 무엇일까? 새로운 연구는 세포 재활용 효율 때문일 수 있다고 시사한다
주의: 주의: 자동 번역 – 오류 가능성
가능한 한 많은 사람들에게 HD 연구 뉴스와 임상시험 업데이트를 최대한 빠르게 전달하기 위해 이 글은 AI가 자동으로 번역했으며 아직 인간 편집자의 검토를 거치지 않았습니다. 정확하고 접근하기 쉬운 정보를 제공하기 위해 노력하고 있지만, AI 번역에는 문법 오류, 오역 또는 불명확한 문구가 포함될 수 있습니다.가장 신뢰할 수 있는 정보를 원하시면 영어 원문을 참조하거나 나중에 사람이 직접 편집한 번역본을 다시 확인하시기 바랍니다. 중대한 문제를 발견하거나 이 언어의 원어민으로서 정확한 번역을 개선하는 데 도움을 주고 싶은 경우 언제든지 editors@hdbuzz.net 으로 문의해 주세요.
헌팅턴병에서는 뇌의 특정 부위가 다른 부위보다 더 빠르게 퇴행한다. 스티븐 핑크바이너 팀은 이러한 차이가 해당 부위의 뇌세포가 변이 헌팅턴병 단백질을 신속하게 식별하고 처리하는 능력의 차이에서 비롯된다고 결론지었다. 특히, 취약한 뇌 영역의 뉴런은 단백질을 가장 느리게 제거한다.
접는 법을 알자
단백질은 세포에 다양한 필수적인 역할을 수행하는 거대 생체 분자이다. 단백질은 아미노산이 특정 순서로 연결되어 만들어진 후, 프레첼처럼 고유한 3차원 형태로 접힌다. 단백질이 올바르게 접혀야만 정상적인 기능을 할 수 있다.
안타깝게도, 일부 단백질은 과정 중에 변형되어 더 이상 올바르게 접히지 않는다. 헌팅턴병에서는 유전적 돌연변이가 헌팅틴 단백질(Htt) 사슬의 아미노산 중 하나가 튀는 레코드판처럼 (혹은 레코드판이 익숙하지 않다면 말더듬처럼) 계속해서 반복되도록 지시한다.
이러한 확장은 헌팅틴 단백질이 잘못 접히고, 세포에 유독해지며, 과학자들이 응집체라고 부르는 큰 덩어리로 뭉치게 한다. 적절한 비유는 배수구를 막는 머리카락 뭉치이다. 흩어진 개별 머리카락은 괜찮지만, 큰 덩어리는 배수구를 막아버린다.
헌팅턴병 환자의 경우, 신체의 모든 세포에 변이 헌팅턴병 단백질이 있는 것으로 보이지만, 질병 중에 우선적으로 죽는 것은 뇌세포이다. 이것이 헌팅턴병이 “신경퇴행성” 질환인 이유이다. 사실, 뇌세포가 죽을 뿐만 아니라, 뇌 내에서도 특정 뉴런 집단이 가장 먼저 죽으므로 가장 취약한 것으로 보인다.
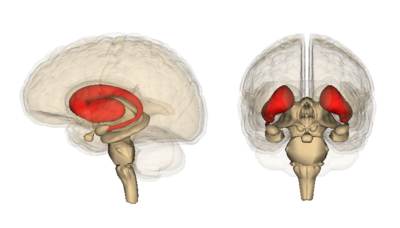
특히, 가장 빠르고 심각한 세포 사멸을 보이는 뇌 영역은 선조체라고 불린다. 선조체는 뇌 중앙 깊숙이 위치한다. 그 역할은 자발적 움직임, 사고, 사회적 상호작용을 조율하고, 상황이 통제 불능이 되지 않도록 보장하는 것이다.
대화를 멈추는 것부터 움직임을 멈추는 것까지 모든 것이 선조체에 의해 관장된다. 매우 중요하지만 현재로서는 이해되지 않는 점은, 다른 영역들은 죽기 전까지 변이 헌팅틴 단백질에 훨씬 더 오래 대처하는 것처럼 보이는 반면, 이 영역이 헌팅턴병에서 퇴행에 왜 그렇게 취약한가 하는 것이다.
“추가 Nrf2로 과부하된 뉴런은 정상보다 변이 헌팅틴 단백질을 더 빨리 제거했으며, 죽을 가능성이 더 낮았다. 이는 세포 자체의 재활용 경로를 강화하는 것이 헌팅턴병의 잠재적인 치료 표적이 될 수 있음을 시사한다.”
서류와 쓰레기, 그리고 변이 헌팅틴을 치우자
샌프란시스코 캘리포니아 대학교의 스티븐 핑크바이너 박사가 이끄는 연구팀은 이러한 차이에 대한 두 가지 가능한 설명을 탐구했다. 한 가지 가능성은 뇌세포 유형 간에 변이 헌팅틴 단백질이 유독한 구조를 형성하는 속도에 차이가 있을 수 있다는 것이다. 기본적으로, 각 세포 유형마다 머리카락이 얼마나 빨리 머리카락 뭉치가 되는가?
세포의 선택적 손실에 대한 또 다른 잠재적인 설명은 뇌의 다른 영역들이 변이 헌팅틴 단백질을 다르게 제거하고 처리할 수 있다는 것이다. 일부 세포는 그저 깔끔쟁이일까?
저자들은 개별 살아있는 배양된 뇌세포에서 이러한 접힘 및 제거 특성을 측정할 수 있는 기술을 고안했다. 그들은 세포를 “덴드라2″라고 불리는 빛나는 단백질로 채웠다. 이 단백질은 처음에는 녹색으로 빛나지만 (아이들 야광봉 장난감처럼), 특정 색상의 빛으로 비추면 붉은색 빛으로 바뀌기 때문에 흥미롭다.
따라서 이 도구를 사용하면 녹색 덴드라2로 가득 찬 뉴런을 배양한 다음, 덴드라2를 붉은색으로 바꾸는 빛으로 비출 수 있다. 세포가 녹색 덴드라2를 보충하고 붉은색 덴드라2를 제거하는 데 걸리는 시간을 관찰하면, 해당 세포가 새로운 단백질을 만들고 (녹색) 오래된 단백질을 분해하는 (붉은색) 속도를 알 수 있다.
이미지 출처: 생명 과학 데이터베이스
물론, 우리는 덴드라2 자체에는 관심이 없다. 우리가 정말 알고 싶은 것은 뇌세포가 정상 헌팅턴병 단백질을 어떻게 처리하는지, 그리고 이것이 헌팅턴병을 유발하는 돌연변이에 의해 변하는지 여부이다. 이 질문에 답하기 위해 과학자들은 정상 또는 변이 헌팅턴병 단백질을 덴드라2 단백질에 융합하는 실험실 기술을 사용했다. 이제 그들은 동일한 빛 기술을 사용하여 헌팅턴병 단백질을 추적할 수 있었다.
쓰레기 처리반의 능력
이 시스템을 사용하여, 그들은 선조체 뉴런에서 변이 헌팅턴병 단백질이 정상 헌팅틴 단백질보다 훨씬 더 빨리 제거된다는 것을 발견했다. 이는 놀라운 일이다. 많은 과학자들은 변이 단백질이 더 오래 남아있을 것이고, 그렇게 남아있는 것이 응집체로 축적되게 할 것이라고 예측했을 것이다. 이는 뉴런이 변이 단백질을 인식하고 제거 대상으로 삼을 수 있음을 시사한다.
사실, 핑크바이너 팀이 개발한 자동 현미경을 통해 그들은 개별 세포가 변이 헌팅틴 단백질을 더 빨리 제거할수록 그 세포가 더 오래 산다는 것을 확인할 수 있었다. 이는 합리적이다. 유독한 쓰레기를 청소하는 것이 뇌세포를 보호하기 때문이다.
그렇다면 세포의 변이 단백질 감지 및 억제 시스템이 작동한다면, 문제는 어디에 있는가? 일부 뉴런, 즉 피질의 뉴런들이 다른 뉴런보다 이 제거 능력이 더 뛰어나다는 것이 밝혀졌다. 피질은 뇌의 주름진 바깥 영역이다. 일반적으로 피질의 세포는 선조체의 세포보다 헌팅턴병에 더 늦게 굴복한다. 그 이유를 이해하기 위해 저자들은 선조체에서의 변이 헌팅턴병 단백질 제거와 피질에서의 제거를 비교했다.
“이 연구의 주요 발견은 뇌의 다른 영역에서 온 뉴런들이 변이 헌팅틴 단백질에 대한 민감도가 실제로 다르다는 것이다. 이는 헌팅턴병이 뇌의 한 곳에서 다른 곳보다 먼저 시작하는 이유에 대한 설명을 제공할 수 있다.”
예상대로, 피질의 뉴런들은 변이 헌팅틴 단백질을 더 빨리 제거할 수 있었다. 피질의 뉴런들은 또한 선조체의 뉴런들보다 더 오래 살았다. 저자들은 이것이 이들 영역이 변이 헌팅턴병 단백질을 제거하는 능력에서 차이가 나는 재활용 경로를 가지고 있기 때문이라고 결론지었다.
단백질이 낡거나 손상되면, 세포는 이를 처리하거나 재활용하는 시스템을 가지고 있다. 연구자들은 그들의 관찰이 이 분해 시스템에 미치는 영향으로 설명될 수 있는지 탐구했다. 특히, 그들은 재활용 경로를 활성화하는 단백질인 Nrf2에 초점을 맞췄다.
과학자들은 특정 과정의 강도를 높이거나 낮춤으로써 다양한 세포 과정이 세포 사멸 및 재활용과 같은 현상에 어떻게 기여하는지 연구할 수 있다. 이 경우, Nrf2 단백질에 의해 활성화되는 재활용 프로그램이 중요하다고 믿었기 때문에, 그들은 세포에 Nrf2를 더 주거나 제거할 수 있었다. 이는 특정 과정이 중요한지 여부를 확립하는 데 도움이 된다.
이것이 바로 그들이 Nrf2와 변이 헌팅턴병 단백질의 재활용을 연구하기 위해 한 일이다. 추가 Nrf2로 과부하된 뉴런은 정상보다 변이 헌팅틴 단백질을 더 빨리 제거했으며, 죽을 가능성이 더 낮았다. 이는 세포 자체의 재활용 경로를 강화하는 것이 헌팅턴병의 잠재적인 치료 표적이 될 수 있음을 시사한다.
이 아이디어와 일치하게, 과학자들이 약물로 세포의 주요 쓰레기 또는 재활용 경로를 인위적으로 감소시켰을 때, 세포는 변이 헌팅턴병 단백질을 제거하는 능력이 떨어졌다. 따라서 이 특정 재활용 경로는 뉴런이 이 유독한 단백질을 처리할 수 있도록 하는 데 중요한 것으로 보인다.

이미지 출처: 크리스 굿펠로우
이것이 HD에 어떤 의미인가?
이 연구의 주요 발견은 뇌의 다른 영역에서 온 뉴런들이 변이 헌팅틴 단백질에 대한 민감도가 실제로 다르다는 것이다. 이는 헌팅턴병이 뇌의 한 곳에서 다른 곳보다 먼저 시작하는 이유에 대한 설명을 제공할 수 있다. 흥미로운 반전은 이러한 민감성이 단백질 자체의 내재적인 독성보다는, 이들 뉴런이 변이 단백질을 관리하고 처리하는 능력의 차이에 기반하는 것으로 보인다는 점이다.
이는 실제로 매우 중요하다. 왜냐하면 뉴런이 변이 헌팅틴 단백질을 관리하는 능력이 잠재적인 치료법의 흥미로운 길을 제공하기 때문이다. 이 연구 결과에 따르면, 뉴런이 변이 헌팅틴 단백질을 제거하는 능력을 향상시키는 치료법이 뉴런이 더 오래 살도록 도울 것이라고 추측할 수 있다.
하지만 이 흥미로운 가능성은 맥락에서 고려되어야 한다. 첫째, 이 연구 전체는 접시에서 배양된 뉴런을 사용하여 수행되었다. 이 현상이 인간 질병에서도 관찰될지는 아직 지켜봐야 하며, 이것이 가장 중요하다.
둘째, 위에서 설명된 가능한 치료법은 아직 존재하지 않으므로 이러한 발견은 예비적이다. 인간에게 시도되기 전에 적절한 것을 고안하고 다른 헌팅턴병 모델에서 테스트하는 데 시간이 걸릴 것이다. 예를 들어, Nrf2 경로가 오랫동안 인위적으로 강화된다면 어떤 해로운 부작용이 발생할지 아무도 모른다.
결론적으로, 이러한 관찰은 매우 흥미로운 기초 헌팅턴병 과학이다. 그리고 헌팅턴병의 근본적인 문제를 공격하는 승인된 약물은 아직 없지만, 이와 같은 연구는 이 끔찍한 상태에 대한 더 나은 이해를 제공하여 신약 개발의 길을 여는 데 도움이 된다.

