HD 치료 설계를 위한 DNA 복구의 어두운면을 밝히다
MSH3라는 유전자는 DNA 복구에 도움이 되지만 HD에서는 CAG 반복이 길어질 수 있습니다. 연구원들은 MSH3 활동이 어떻게 제어되는지에 대한 새로운 정보를 발견하여 새로운 치료 방법의 문을 열었습니다.
우리의 DNA를 고정하고 유지하는데 관여하는 단백질을 암호화하는 ‘MSH3’라는 유전자는 여러 유전 연구에서 질병의 주요 원인으로 연루된 이후 Huntington의 연구에서 뜨거운 화제가 되었습니다. 최근 간행물에서 골웨이 아일랜드 국립 대학의 과학자 팀은 MSH3 단백질이 우리 세포 내에서 어떻게 조절되는지에 대한 통찰력을 제공하여 HD를 늦추거나 심지어 예방하는 것을 목표로 하는 약물의 설계를 알리는데 도움이 될 수 있습니다.
MSH3 – 양날의 검
MSH3 단백질 분자는 유전적 오류를 수정하고 매일 매일 직면하는 DNA 손상의 지속적인 공격으로부터 우리의 게놈을 보호합니다. 그것은 우리의 DNA를 따라 스캔하고, 오류를 찾고, ‘불일치 복구’라는 과정에서 수정하는데 도움이 되는 다른 단백질을 모집함으로써 이를 수행합니다.

아시다시피 헌팅턴병은 “헌팅틴"이라는 유전자 내에서 비정상적으로 길게 반복 된 ‘C’- ‘A’- ‘G’DNA 염기 (유전 코드의 구성 요소)에 의해 발생합니다. HD의 영향을받는 뇌 영역에서 이 반복적인 DNA는 ‘불안정’합니다. 즉, 평생 동안 더 많은 반복 단위가 추가 될 수 있습니다. 이 과정을 ‘DNA 반복 확장’또는 신체 불안정성이라고합니다. HD와 같은 대부분의 반복 확장 질환의 경우, 반복 횟수가 길수록 질병 증상이 악화됩니다.
MSH3가 DNA에서 이 CAG 반복을 발견하면 오류로 인식하고 수정하려고 하지만 대신 더 많은 반복을 도입하여 문제를 더욱 악화시킵니다!
어떻게 이를 예방할 수 있을까요?
MSH3가 이러한 실수를 저지르는 것을 막는 약물을 만들 수 있다면 반복적인 확장 과정을 늦추거나 예방할 수 있습니다. 이로 인해 우리는 질병을 늦출 수 있기를 바랍니다. 하지만 MSH3의 유전 암호를 보호하는 정상적인 기능을 방해하지 않고 어떻게 할 수 있을까까? 일반적으로 DNA 복구 유전자가 없으면 암과 같은 DNA 손상의 축적을 통해 모든 종류의 문제가 발생할 수 있습니다. MSH3에 대해 정말 흥미로운 점은 반복 확장 과정에 관여하는 것으로 알려진 다른 DNA 복구 단백질과 달리 MSH3를 완전히 제거해도 부작용이 많지 않은 것 같습니다. MSH3이 없을 때를 대비한 훌륭한 커버 시스템을 갖추고 있어 약물 치료가 가능한 이상적인 표적이 됩니다.
새로운 소식 있나요?
“MSH3가 이러한 실수를 저지르는 것을 막는 약물을 만들 수 있다면 반복적인 확장 과정을 늦추거나 예방할 수 있으며, 이는 질병을 늦출 수 있기를 바랍니다.”
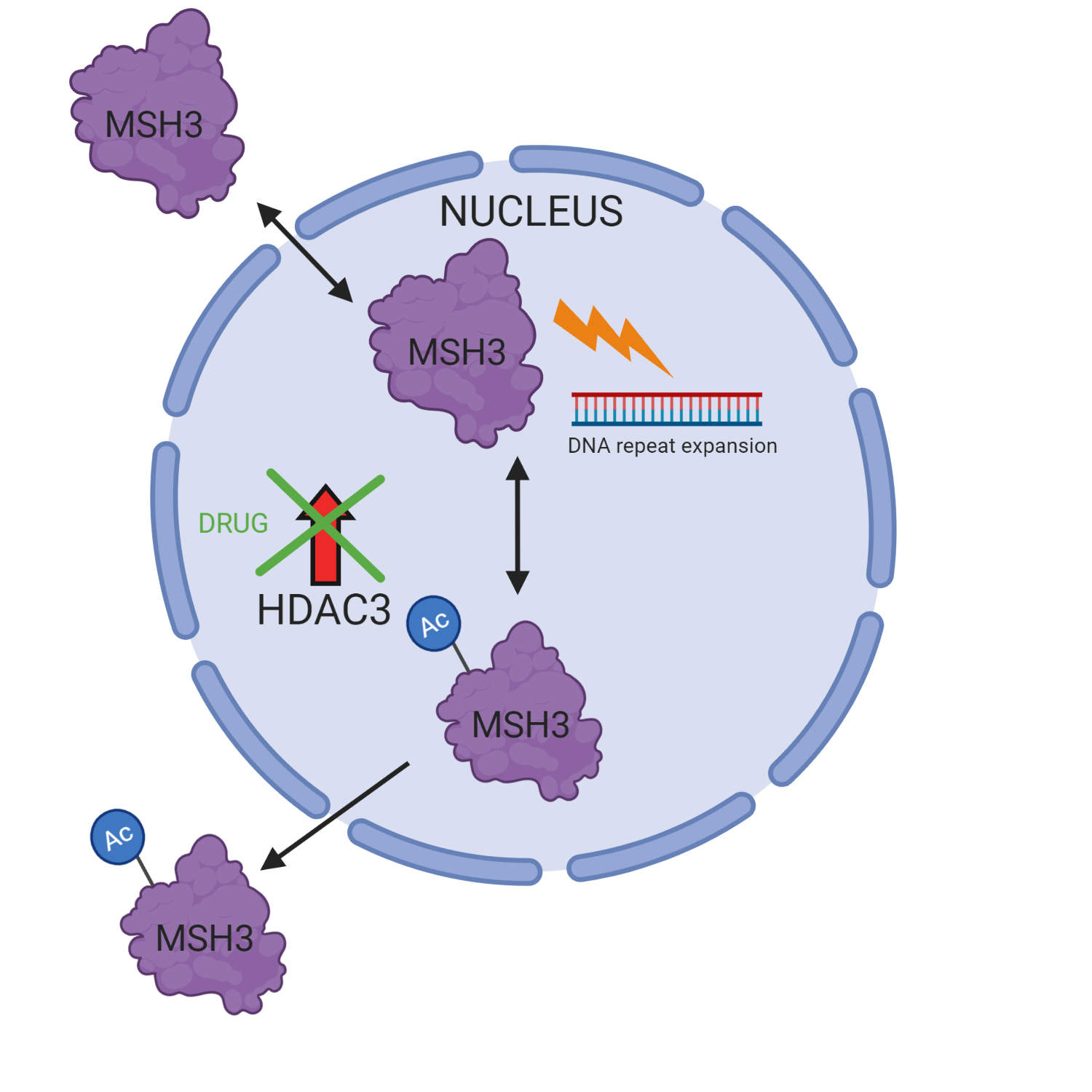
우리의 세포는 아세틸 그룹이라는 화학적 특징을 추가하여 MSH3 단백질이 더 느리게 작동하도록 할 수 있으며, 아세틸 그룹을 제거하여 더 빠르게 작동하도록 만들 수 있습니다. MSH3가 더 빨리 작동하면 DNA 반복 확장이 더 빨라지기 때문에 과학자들은이 아세틸 마크가 지워지는 것을 방지하기를 원합니다. 이전 연구는 HDAC3라는 단백질이 제거 과정에 관여한다고 제안했습니다. 골웨이 아일랜드 국립 대학교의 Laheu 실험실은 HDAC3가 제대로 작동하지 못하게 하는 인간 세포에서 약물을 테스트하고 DNA 반복 확장에 미치는 영향을 조사했습니다.
그들은 무엇을 찾았습니까?
그들은 약물이 인간 세포에서 CAG 반복 확장을 중단 시켰음을 발견했고, 가장 중요한 것은 그것이 다른 중요한 DNA 복구 활동에 영향을 미치지 않는다는 것을 발견했고, 이는 이 치료법이 암 위험을 증가시키지 않을 것이라고 제안했습니다. 연구원들은 또한 HDAC3가 MSH3 활동을 제어하는 방법에 대해 더 많이 이해하기 위해 이 약물을 사용했습니다. 단백질 분자에는 ‘Nuclear Localization Sequences'(또는 줄여서 ‘NLS’)라는 특수 신호가 있는데, 이는 단백질을 DNA가 보관된 핵으로 보내는 우편 번호처럼 작동합니다. 그들은 아세틸 마크가 MSH3의 우편 번호를 변경하여 더 이상 DNA 반복 확장을 유도 할 수 없는 핵 밖으로 향하게 한다는 것을 깨달았습니다.
이게 다 무슨 의미일까요?
전반적으로, 그들의 연구는 HDAC3에 의해 MSH3에서 아세틸 그룹을 제거함으로써 DNA 반복 확장에 대한 새로운 조절 메커니즘을 제안합니다. 이것은 예를 들어 아세틸 그룹이 제거하기 더 어려운 경우 특정 버전의 MSH3 환자가 질병 진행이 느린 이유에 대한 설명을 제공 할 수 있습니다.
이러한 방식으로 질병 메커니즘을 이해하면 DNA 확장 과정 (그리고 다시 질병 자체)을 늦추는 것을 목표로하는 약물 설계의 문이 열립니다. 특히 HDAC3 억제가 DNA 불일치 복구의 핵심 기능에 영향을 미치지 않는다고 주장하기 때문입니다. 이 연구에서 그들이 사용한 약물은 강력하고 선택적이며 상당히 잘 연구되었으므로 이미 그 자체로 유망한 임상 후보가 될 수 있습니다.
즉, HDAC를 엉망으로 만드는 것은 세포에 모든 종류의 원치 않는 영향을 미칠 수 있습니다. HDAC3를 표적으로 하는 약물이 제한된 부작용으로 안전한지 확인해야 합니다. 더욱이, 우리는 HDAC3 억제제를 매우 어려운 경향이 있는 헌팅턴병에 영향을 받는 뇌의 깊은 영역에 전달하는 방법을 찾아야 할 것입니다.
요약하면, 그들의 작업은 가능성을 보여 주지만, 우리가 잠재적 인 치료법으로 기대하기 전에 훨씬 더 많은 작업을해야합니다.