이 기사의 최신 버전이 있지만 아직 번역되지 않았습니다.
우리는이 기사를 번역하기 위하여 노력하고 있습니다. 번역이 안됐을 경우 영어와(과) 독일어에서 원문을 찾아 보실 수 있습니다.
헌팅턴병 치료제 컨퍼런스 2022 - Day 1
2022 HD Therapeutics Conference #HDTC2022 1일 차의 연구 업데이트를 확인하세요.


 작성자 Dr Rachel Harding, Dr Leora Fox, Dr Sarah Hernandez, Joel Stanton 2022년 05월 12일 (목) Dr Sarah Hernandez에 의해 편집 됨 Prof Wooseok Im에 의해 번역됨 2022년 03월 03일 (목)에 발표된
작성자 Dr Rachel Harding, Dr Leora Fox, Dr Sarah Hernandez, Joel Stanton 2022년 05월 12일 (목) Dr Sarah Hernandez에 의해 편집 됨 Prof Wooseok Im에 의해 번역됨 2022년 03월 03일 (목)에 발표된
화창한 팜스프링스의 좋은 아침입니다! COVID로 인해 2년 동안 중단된 HD Therapeutics Conference가 올해 HD 연구원의 가장 큰 연례 모임인 직접 대면으로 돌아옵니다! 트위터 업데이트는 아래에 정리되어 있습니다. 해시태그 #HDTC2022를 사용하여 나머지 회의에 대한 실시간 업데이트를 계속 팔로우하세요.
첫째 날은 전 세계 최고의 HD 연구실의 연구 업데이트에 중점을 둡니다.
헌팅틴 단백질 빌딩 블록
Paolo Beuzer 박사(CHDI)와 Vanessa Wheeler 박사(MGH)는 헌팅틴 DNA 및 RNA에서 CAG 반복을 연구하고 잠재적으로 조작하는 방법에 초점을 맞춘 연구 회담의 첫 번째 세션을 소개합니다.
CAG 반복 – 보기보다 복잡합니다.
오늘의 첫 번째 연사는 University of Glasgow의 Darren Monckton입니다. Monckton 연구실은 헌팅턴병과 같은 질병에서 DNA 서열의 반복을 연구합니다.
CAG 반복은 너무 짧아서 단순해 보이지만 실제로는 상당히 복잡합니다. CAG 반복의 크기만으로는 HD 증상이 나타날 연령을 설명할 수 없습니다. CAG는 단백질 빌딩 블록 글루타민에 대한 코드입니다. 그러나 다른 단백질 문자도 글루타민을 암호화할 수 있습니다. 그 중 하나는 HD의 폴리글루타민에도 기여할 수 있는 CAA입니다. 이러한 CAA 중단은 증상이 나타나는 연령에도 영향을 줄 수 있습니다. 드물게 CAA 중단이 발생하면 순수한 CAG 반복만 있는 HD 환자에 비해 발병 연령이 더 빨라집니다. CAG 반복 경로의 “순도” 변화, 즉 이러한 중단이 있는지 여부는 우리가 여기에 썼던 체세포 불안정성이라는 프로세스에 영향을 미칠 수 있습니다. https://en.hdbuzz.net/291
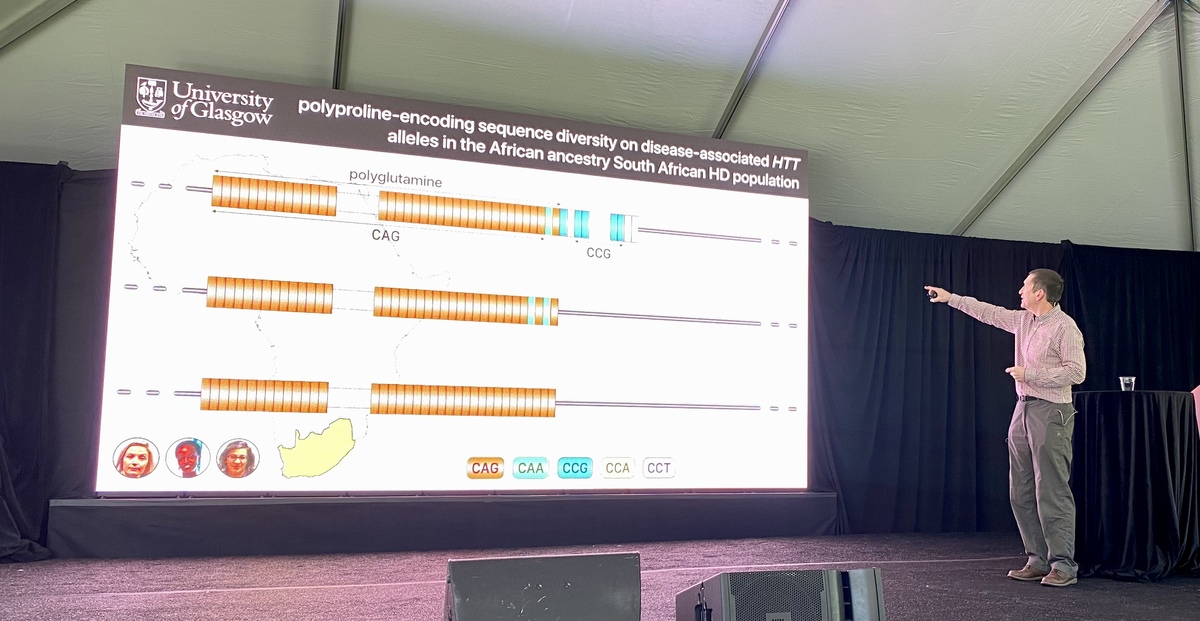
이러한 관찰이 이루어진 EnrollHD 데이터베이스는 많은 유럽 및 북미 사람들의 데이터로 편향되어 있지만 세계 다른 지역의 데이터는 아닙니다. Monckton 연구소는 남아프리카 공화국의 한 그룹과 협력하여 이 문제를 해결하기로 결정했습니다. 이 남아프리카 인구에서 Monckton 연구실은 이러한 중단 여부에 관계없이 다양한 유형의 CAG 소로의 매우 유사한 분포를 보았습니다. 그러나 HTT 유전자의 다른 부분에는 약간의 차이가 있었습니다…
CAG 다음에 HTT 단백질에는 프롤린이라는 단백질 빌딩 블록을 구성하는 문자인 CCG가 포함됩니다. Monckton 연구실은 남아프리카 공화국의 HD 환자가 얼마나 많은 프롤린을 가지고 있는지 시퀀싱하여 이 단백질 영역이 유럽 혈통의 HD 환자와 다르다는 것을 발견했습니다. 그들은 이 데이터를 사용하여 프롤린 반복의 수와 이러한 프롤린 반복을 구성하는 문자가 발병 연령에 미치는 영향을 확인했습니다. 철자가 약간 다른 프롤린이 있는 HD를 가진 사람들은 HD 증상이 10년 더 일찍 발병했습니다. 이러한 단백질 구성 요소의 철자를 추적하는 것은 질병 발병 시 연령의 진단 또는 예측을 개선하는 데 도움이 될 수 있습니다. 전반적으로 이것이 의미하는 바는 헌팅틴 유전자 조리법의 다른 변화가 질병에 영향을 미칠 수 있다는 것입니다. HD 유전학은 처음 보이는 것보다 훨씬 더 성가시고 복잡한 것으로 판명되고 있습니다. 더 일찍 또는 더 늦게 증상 발병으로 이어지는 이러한 변이를 이해하면 연구자들이 HD를 가진 사람들을 위한 의약품을 만드는 새로운 방법을 찾는 데 도움이 될 수 있습니다. 그것이 희망입니다.
연구자들은 헌팅틴 제조법의 이러한 다른 변화가 체세포 불안정성에 영향을 미치는 것이 아니라 헌팅틴 제조법이 전달하는 메시지에 영향을 미치고 있다고 결론지었습니다. mRNA 메시지 분자 구조가 변경될 수 있습니다. 흥미롭게도, 우리가 방금 설명한 어떤 변화도 헌팅틴 단백질 자체를 변화시키지 않습니다. 그들은 유전자의 철자 또는 “레시피"만 변경합니다. 이것은 질병에 영향을 미치는 것은 단백질과 관련된 변화가 아니라 RNA 수준의 변화임을 시사합니다. RNA의 철자를 바꾸면 분자가 접히는 방식이 바뀔 수 있습니다. 이러한 접히는 변화가 무엇을 의미하는지 아직 아무도 모르지만 치료제를 개발하는 데 활용할 수 있습니다.
Monckton 박사는 모든 것이 너무 단순해 보이지만 - HD를 가진 사람들이 CAG 반복 횟수를 늘렸다는 사실 - 사실은 매우 복잡하다고 결론지었습니다! 그러나 이와 같은 연구는 우리가 신약을 설계하기 위해 이 복잡성을 어떻게 활용할 수 있는지에 대한 것입니다.
HD가 뇌의 개별 세포에 어떤 영향을 미치는지 조사
다음은 Harvard Medical School 및 Broad Institute와 제휴한 Steve McCarroll입니다. 스티브는 뇌의 단일 세포 수준에서 HD를 이해하는 연구에 대해 이야기할 것입니다.
뇌는 특정 기능을 수행하는 다양한 세포 유형으로 구성되어 있습니다. McCarroll 박사는 이렇게 다양한 유형의 세포가 HD의 영향을 받는 방식을 이해할 필요가 있음을 강조합니다. 그의 연구실은 다양한 유형의 세포를 분리하고 유전학을 이해하기 위해 특수 기술을 사용합니다. 그들은 HD 연구 커뮤니티 전체에 혜택을 주기 위해 방법론을 널리 공유하기 위해 최선을 다하고 있습니다.
McCarroll 박사는 분석 속도를 높이는 방법을 찾았습니다. 그는 HD 환자의 인간 뇌 샘플을 결합한 다음 데이터를 분리합니다. 데이터를 더 빨리 얻는 것은 연구원이 가능한 한 빨리 답변을 얻을 수 있기 때문에 큰 이점입니다. 이러한 유형의 대규모 분석은 HD 환자가 통과한 후 뇌 기증을 통해 가능합니다. HD 연구에 대한 뇌 기증은 우리가 HD 치료에 관심을 갖고 있는 유일한 유기체인 사람에서 HD에 대한 답을 현장에서 얻을 수 있는 주요 방법입니다.
McCarroll 연구실은 HD 증상이 진행됨에 따라 뇌에 있는 다양한 종류의 세포 비율이 어떻게 변하는지 이해하기 위해 이러한 기술을 적용하고 있습니다. 그의 연구실은 질병이 진행됨에 따라 이러한 변화를 정의했으며, 이는 HD 환자의 뇌 세포 구성을 이해하는 데 도움이 됩니다. HD가 있는 대부분의 사람들에게는 중간 가시 뉴런이라고 하는 세포의 상당한 손실이 있습니다. 연구자들은 이것을 잠시 동안 알고 있었지만 McCarroll 박사는 또한 뇌의 다른 많은 세포 유형에서 세포 변화가 있음을 보여주었습니다. 세포의 손실은 유전자가 켜지고 꺼지는 변화를 동반합니다. McCarroll 박사는 질병이 진행됨에 따라 각 세포 유형에서 이러한 유전자의 이러한 변화를 매핑했습니다. 와우!
이러한 유형의 데이터는 질병을 수정하는 특정 세포 내의 다른 유전자를 식별할 수 있습니다. 이러한 질병 관련 변형 중 하나는 HD 연령의 사람으로서 CAG 반복의 확장과 관련이 있습니다.
HD를 가진 특정 사람들은 특히 뇌에서 시간이 지남에 따라 CAG 반복이 증가합니다. 이러한 확장은 HD 환자의 발병 연령을 증가시킬 수 있습니다. 이러한 확장의 원인을 이해하면 질병 발병을 지연시키는 의약품을 개발하는 데 도움이 될 수 있습니다. 유전자 변형자로 알려진 다른 유전자는 사람의 CAG 반복이 시간이 지남에 따라 확장되는지 여부와 확장에 영향을 미칩니다. McCarroll의 연구실은 많은 사람들의 개별 세포 내에서 이러한 수정자를 찾고 있습니다!
이러한 프로세스가 작은 수준에서 어떻게 변하는지 알면 다양한 세포 유형에서 CAG 확장이 어떻게 변화하고 있으며 이것이 질병 진행에 어떤 영향을 미치는지에 대한 수많은 정보를 제공할 많은 데이터를 생성합니다. 흥미롭게도 그는 이러한 CAG 확장이 HD에 의해 가장 영향을 받는 세포 유형 중 하나인 중간 가시 뉴런에서 훨씬 더 많이 발생한다는 것을 발견했습니다. 이것은 이 특정 세포 유형이 HD에서 매우 취약한 이유 중 하나일 수 있습니다. 그는 또한 뇌의 다양한 세포 유형과 뇌의 다양한 영역에서 이러한 변화를 정의했습니다. 특정 세포 유형이 있는 뇌의 위치에 따라 해당 세포 유형의 CAG 확장에도 영향을 미칠 수 있습니다. 따라서 셀 ID뿐만 아니라 셀 위치도 중요합니다! 뇌의 세포 유형과 "이웃"이 모두 CAG 확장에 영향을 미치는 이유를 이해하는 것은 이를 퇴치하기 위한 치료법을 개발하기 위한 중요한 다음 단계가 될 것입니다. McCarroll 연구소의 이 데이터는 언론에서 뜨거운 관심을 받고 있으며 연구소 및 분석 기술의 최근 혁신을 반영합니다. 그들은 HD의 다양한 단계를 가진 사람들의 더 많은 샘플에 이러한 기술을 적용할 계획입니다.
HD 마우스 모델
다음 연사는 로스앤젤레스 캘리포니아 대학의 William Yang 박사이며 그의 연구실이 최근 개발한 그의 새로운 마우스 모델에 대해 이야기할 것입니다. 우리는 최근에 이 새로운 모델에 대해 썼습니다: https://en.hdbuzz.net/318
HD 연구에 완벽한 HD 마우스 모델은 없지만 다양한 유형이 질병의 다양한 측면을 포착하고 다양한 유형의 실험을 허용할 수 있습니다. 수년 동안 Yang 연구소는 HD에 대한 특정 질문에 답하기 위한 마우스 모델 제작을 전문으로 해왔습니다. 일부 마우스 모델에는 변경된 유전자 발현 또는 단백질 응집과 같은 HD의 특정 기능만 있기 때문에 특정 실험에 적합한 모델을 선택하는 것이 중요합니다. 의 주요 혁신
Yang lab의 새로운 마우스 모델은 시간이 지남에 따라 특정 세포에서 CAG의 성장이 반복되는 체세포 불안정성을 보여줍니다. 이를 통해 연구자는 확장이 생쥐의 건강과 행동에 미치는 영향을 이해할 수 있습니다. 이 쥐에서 CAG 반복이 더 확장될수록 행동과 뇌 세포 건강이 더 많이 영향을 받아 인간의 혈액, 척수액 및 뇌 기증 데이터를 기반으로 우리가 의심했던 것을 동물에서 처음으로 확인했습니다. 실험실은 이제 그들의 새로운 마우스 모델을 사용하여 불안정하고 확장되는 CAG 반복이 헌팅틴 제조법과 단백질에 영향을 미치고 세포에 미칠 수 있는 피해를 더 잘 이해합니다.
Yang 박사는 또한 HD가 진행되는 동안 유전자가 어떻게 켜지고 꺼지는지 연구할 수 있는 다른 유형의 HD 마우스 모델의 데이터를 공유했습니다. (McCarroll 연구실 및 기타 연구실과 함께) 이 질문에 여러 각도에서 접근하는 것을 보니 정말 좋습니다. 우리는 지금 잠시 휴식을 취하고 있지만 오늘 아침의 나머지 연사들의 업데이트로 곧 돌아올 것입니다. 계속 지켜봐 주세요!
헌팅틴 메시지 처리
다음 연사는 University College London의 Queen Square Institute of Neurology의 Gillian Bates 박사입니다. Bates 박사는 어떻게 헌팅틴 유전자가 처리되고 이 정보를 사용하여 치료제를 개발할 수 있는지에 대해 업데이트할 것입니다.
헌팅틴 유전자는 코드 사이에 있는 유전 정보의 작은 비트를 제거하기 위해 "접합"됩니다. 그런 다음 유전자는 단백질이 만들어지기 전에 다시 결합됩니다. 이 과정은 일반적으로 단일 유전자에서 생성할 수 있는 정보의 다양성을 세포에 제공하는 데 사용됩니다. 그러나 이 프로세스는 HD에서 잘못될 수 있습니다. HD에서 헌팅틴 유전자는 "엑손 1"이라고 하는 매우 작은 단백질 단편을 만드는 데 사용됩니다. 이 엑손 1은 CAG 반복을 포함하며 세포에 매우 유독합니다.
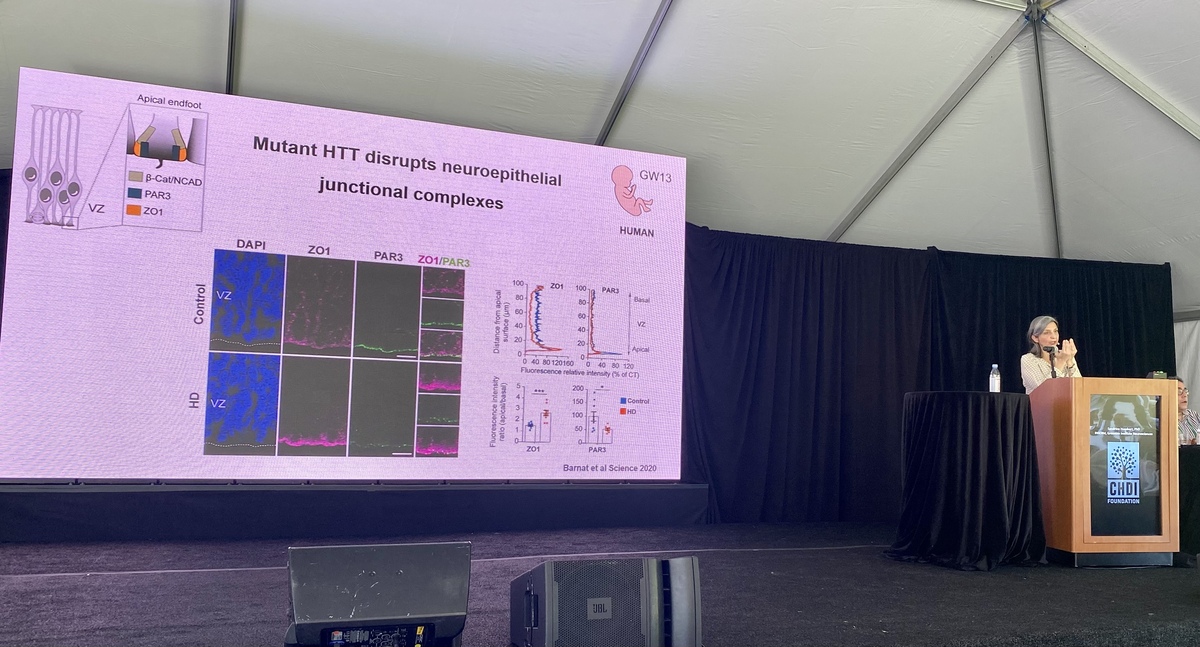
Bates 박사는 HD 마우스 모델과 HD 환자의 다양한 뇌 영역에서 엑손 1의 양을 조사했습니다. 그녀는 CAG 반복이 길수록 exon1 단백질을 만드는 스플라이싱 과정이 더 자주 발생한다는 것을 발견했습니다. Bates 연구실은 접합에 의해 생성된 헌팅틴 단백질의 다양한 형태와 조각을 감지하고 구별하는 방법을 실험하고 있습니다. 그들은 단백질의 다른 부분을 감지하는 방법인 서로 다른 항체 조합을 사용하여 이를 수행합니다. 이 작업은 엑손 1 단편이 단백질 응집 생성 부위임을 시사합니다. 이 과정이 어떻게 발생하는지 이해하면 이러한 단백질 덩어리를 줄이는 방법에 대한 많은 단서를 얻을 수 있습니다.
Bates 연구실은 새로운 마우스를 만들고 다른 화학 물질로 조직을 처리하는 것과 같이 현미경이나 분석에서 다양한 형태의 단백질을 시도하고 볼 수 있는 혁신적인 방법을 전문으로 합니다. 그들은 splicing 패턴이 변경된 특별한 마우스 모델을 만들었고 헌팅틴 단백질의 exon1 단편이 더 이상 만들어지지 않아야 합니다. 이 마우스에서 실험실은 일반 HD 마우스 모델과 비교하여 생성되는 독성 단백질 덩어리의 수준을 관찰했습니다. 새로운 마우스 모델에서는 exon1 단편이 덩어리를 만드는 데 중요함을 시사하는 덩어리가 훨씬 적었습니다. 다음 단계는 헌팅틴 덩어리의 차이가 쥐의 행동과 뇌 세포 간의 의사 소통 패턴을 어떻게 변화시킬 수 있는지 탐구하는 것입니다. 때때로 헌팅틴 덩어리는 유전 물질을 수용하는 세포의 일부인 세포 핵 근처에 나타납니다. Bates 연구실은 여러 모델을 사용하여 이것이 마우스 헌팅틴이 아닌 인간 헌팅틴에서만 발생한다는 것을 보여주었습니다. 이러한 데이터는 이러한 병원성 단백질 덩어리를 유발하는 인간 헌팅틴에 고유한 무언가가 있음을 시사합니다. 이것은 인간이 자연적으로 HD를 얻을 수 있는 유일한 종인 이유에 대한 단서가 될 수 있습니다!
어떤 형태의 헌팅틴이 가장 독성이 있고 왜 (인간!) 뇌 세포에 미치는 부정적인 영향을 퇴치하기 위한 약물을 설계하는 데 도움이 될 것입니다.
헌팅틴 단백질의 세포 처리
다음은 스탠포드 대학의 Dr. Judith Frydman입니다. 그녀는 CAG 반복 확장이 뇌 세포의 "쓰레기 태깅 및 처리” 시스템에 문제를 일으킬 수 있는 이유에 대해 이야기할 것입니다.
우리는 HD의 원인을 알고 있지만 연구원들은 헌팅틴 단백질의 “정상적인” 기능을 진정으로 알지 못합니다. 그들이 아는 것은 세포의 스위스 군용 칼과 같은 다양한 생물학적 과정에 참여한다는 것입니다. 이 때문에 연구자들은 HD가 다른 유전자의 파괴 또는 다른 단백질의 파괴로 인한 질병인지 논쟁을 벌입니다. Frydman 박사의 연구는 HD가 적어도 부분적으로는 단백질 수준의 붕괴로 인해 발생한다고 주장합니다.
Frydman 박사의 연구는 mRNA라고 하는 헌팅틴 메시지 분자가 번역이라는 과정을 통해 어떻게 단백질 분자로 전환되는지 이해하는 데 중점을 둡니다. 세포에 대한 스트레스(바이러스 감염, 단백질 빌딩 블록의 가용성 감소, 세포 기계 작동 방식의 변화 등)는 번역이 발생하는 방식을 변경할 수 있습니다. 연구자들은 HD가 있는 사람이나 동물 모델의 세포가 세포 스트레스를 증가시킨다는 것을 알고 있습니다. Frydman 박사의 연구실은 이러한 스트레스 조건에서 더 많은 헌팅틴 단백질이 생성된다는 모델을 보여주었습니다. 세포가 번역을 통해 헌팅틴 단백질을 만들 때 리보솜이라는 기계를 사용합니다. Frydman과 동료들은 세포가 돌연변이 헌팅틴을 만들 때 리보솜이 충돌하여 헌팅틴 메시지에 교통 체증을 유발한다는 것을 보여줍니다. Frydman 연구실은 교통 체증이 있거나 없는 메시지에서 어떤 유전자가 변경되었는지 살펴보았을 때 이러한 유전자 중 많은 수가 세포의 단백질 정리와 관련되어 있음을 발견했습니다.
HD 모델에서는 eIF5A라는 단백질이 고갈됩니다. eIF5A는 리보솜이 교통 체증을 제거하는 데 중요하므로 HD에 이 단백질이 적으면 새로운 단백질 분자를 만들고 오래된 것을 제거하는 데 더 많은 문제가 발생합니다. 함께, Dr. Frydman의 연구는 HD로 인한 분자 붕괴의 전체 호스트가 RNA 메시지와 헌팅틴 단백질 수준 모두에서 발생하며, 각각은 우리가 환자와 HD 모델에서 볼 수 있는 HD의 징후와 증상에 기여한다고 제안합니다.
헌팅틴으로 인한 질병영향
두 번째 세션은 Balajee Somalinga 박사(CHDI)와 Ali Brivanlou 박사(The Rockefeller University)가 주최하며 주로 헌팅틴 메시지와 단백질, 건강과 질병에서의 역할에 중점을 둘 것입니다.
헌팅틴으로 인한 초기 효과
이 세션의 첫 번째 연사는 INSERM의 Sandrine Humbert로 뇌 발달 중 헌팅틴 단백질의 역할에 대한 그녀의 연구에 대해 이야기할 것입니다. 헌팅틴 단백질은 세포에서 많은 역할을 하며 그 중 하나는 세포 주변의 다른 분자를 움직이는 것입니다. 헌팅틴이 신경 세포에서 수송을 돕는 분자 중 하나는 뇌 세포의 건강을 지원하는 데 중요한 BDNF입니다. 헌팅틴 단백질의 정상적인 형태와 확장된 형태는 모두 생명의 초기 단계에 있는 세포에 의해 만들어집니다. Humbert 연구실은 HD를 가진 사람들의 확장된 형태의 단백질로 인한 오류가 나중에 그들이 겪는 증상의 원인이 될 수 있다고 생각합니다. Humbert 연구실은 헌팅틴이 이러한 세포가 원래 어떻게 형성되었는지, 최종 구조, 궁극적으로 어떻게 작동하고 다른 신경 세포와 연결되는지를 포함하여 신경 세포 발달의 많은 기능에 중요하다는 것을 발견했습니다. Humbert 연구실에서 작업하는 HD 마우스 모델에서는 이러한 발달이 제대로 이루어지지 않아 나중에 이 마우스에서 나타나는 신경변성이 설명될 수 있습니다. 우리는 이 작업에 대해 이전에 여기에서 썼습니다: https://en.hdbuzz.net/290 Dr. Humbert는 HD 뇌의 세포가 연결되는 방식의 변화가 HD 환자가 일반적으로 증상을 나타낼 때 이후에 그들을 취약하게 만든다고 가정합니다.
그녀의 연구실의 최신 연구는 HD가 신경 세포 성장, 구조 및 운동에 미치는 영향을 포함하여 건강 및 HD에서 헌팅틴의 역할을 계속 탐구합니다. 건물의 지지대와 유사한 뉴런 구조 내에서 더 많은 안정성을 만드는 것은 나중에 건강에 긍정적인 영향을 미치는 것으로 보입니다.
요약하면, HD 모델에서 신경 세포 발달이 다르지만 신경 세포는 매우 탄력적이며 증상이 나타나기까지 수십 년이 걸릴 수 있습니다.
다른 종의 헌팅틴
다음은 밀라노 대학의 Raffaele Iennaco 박사와 Istituto Nazionale di Genetica Molecolare입니다. 그의 연구는 줄기 세포를 사용하여 헌팅틴 엑손1 단편의 구조가 기능에 미치는 영향을 이해합니다.
Iennaco 박사는 Elena Cattaneo 박사의 연구실에서 “유도 만능 줄기 세포” 또는 iPSC로 알려진 특수한 형태의 줄기 세포 사용에 중점을 두고 있습니다. HD 환자에서 추출한 이 세포를 통해 팀은 Huntingtin 단백질의 시작 부분을 연구할 수 있습니다. 이 작은 조각은 Huntingtin 단백질의 아주 작은 부분을 반영합니다. 전체 단백질의 3% 정도입니다. 그러나 이 작은 조각은 세포에서 헌팅틴의 작업, 특히 세포 주위를 움직이는 방식에서 엄청난 역할을 합니다.
헌팅틴 단백질의 이 작은 부분을 더 잘 이해하기 위해 Iennaco 팀은 209개의 다른 동물 종에서 이 영역의 정확한 서열을 결정했습니다! 이것은 우리가 이런 종류의 정보를 가지고 있는 종의 수를 극적으로 증가시킵니다.
종에 따라 CAG의 수는 상당히 다양합니다. 물고기의 경우 항상 4개의 CAG인 것처럼 보이지만 도마뱀의 경우 5개인 반면 HD가 없는 인간의 CAG 반복은 17-20개입니다. 종마다 다른 양의 CAG가 필요한 이유는 Iennaco가 이해하는 데 관심이 있는 큰 미스터리입니다. Iennaco의 연구에서 얻은 다른 증거에 따르면 헌팅틴 유전자는 돌연변이를 받아들일 수 없습니다. 헌팅틴의 유전 코드에는 우연히 예상되는 것보다 훨씬 적은 변화가 있습니다. 헌팅틴 유전자의 중요성에 대한 추가 증거. 마모셋에서 - 아주 귀여운 원숭이 경험을 위해 Google로 이동하십시오 - 실제로 두 개의 Huntingtin 유전자가 있습니다! 이것은 연구된 다른 종에서는 해당되지 않지만 헌팅틴 유전자를 더 잘 이해하기 위해 희귀 유전적 사건의 예를 찾기 위해 200종 이상의 종을 조사하는 힘을 시사합니다. Iennaco 팀은 실험실에서 자라는 줄기 세포를 사용하여 CAG 반복 영역의 길이와 이러한 세포가 뉴런이라는 뇌 세포로 발달하는 능력 사이의 정확한 연관성을 연구할 수 있었습니다. 이 실험은 염기서열 분석에서 확인된 모든 유전적 다양성의 중요성을 이해하는 데 도움이 됩니다.
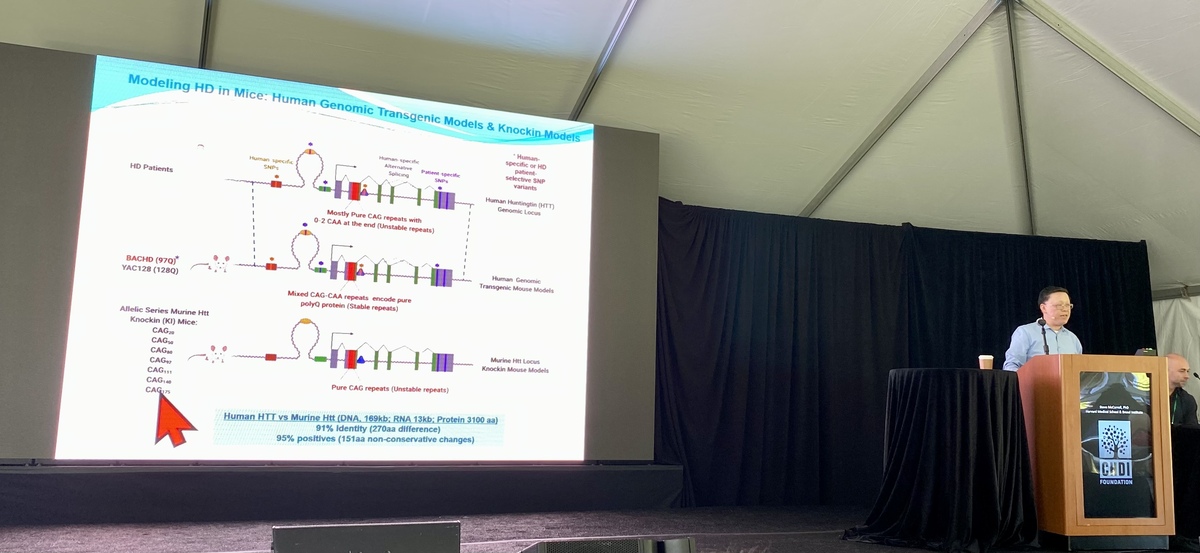
다음으로 Iennaco와 팀은 마우스와 인간 헌팅틴의 비교에 집중했습니다. 이상하게도 인간 헌팅틴 유전자는 매우 유사하지만 마우스 버전보다 독성이 더 강한 것으로 밝혀졌지만 그 이유는 모릅니다. 팀은 접시에서 자란 줄기 세포가 뇌 발달의 가장 초기 단계를 거치도록 유도할 수 있습니다. 이를 통해 작은 변화(CAG 길이 또는 종 전체)의 중요성을 연구하고 뇌 발달에 미치는 영향을 측정할 수 있습니다. 매우 멋진 자동화 시스템을 사용하여 팀은 Huntingtin 시퀀스의 작은 변화가 미치는 영향을 더 잘 이해하기 위해 실험실에서 약 5,000개의 서로 다른 미니 두뇌의 이미지를 촬영했습니다.
그들이 측정한 새로운 뇌 세포 성장의 많은 측면은 마우스 헌팅틴보다는 인간 헌팅틴의 영향을 더 많이 받았습니다. 이것은 새로 태어난 뇌 세포에 유독할 수 있는 능력이라는 점에서 인간 염기서열과 구별되는 무언가가 있음을 시사합니다. 팀은 헌팅틴 유전자의 매우 특정한 영역을 좁혀서 HD 유전자의 인간 버전이 쥐의 것보다 독성이 더 강한 이유를 설명한다고 생각합니다. 이것은 동물에서 이와 같은 유전 연구의 중요성을 뒷받침합니다.
성상교세포의 헌팅틴에 의한 영향
다음은 UCLA의 Baljit Khakh 교수의 강연입니다. 그의 연구실은 HD에서 성상교세포라고 하는 특정 유형의 지지 세포에 관심이 있습니다. 이것들은 HD에서 가장 취약한 세포(뉴런)가 아니지만 인생에서 성상교세포는 뉴런을 지원하는 역할을 합니다. 성상교세포는 HD 초기에 죽지 않지만 HD 유전자를 확실히 발현하며 HD 유전자의 돌연변이 사본을 발현할 때 모양과 기능에 많은 변화를 보입니다. Khakh의 연구실은 성상세포의 이러한 변화가 HD에 영향을 미치는지 여부를 알고 싶어합니다. Khakh의 연구실은 HD 환자의 뇌에서 생성된 거대한 데이터 세트와 어떤 유전자가 켜지고 꺼지는지 보여주는 동물 모델을 살펴보고 성상세포가 제대로 작동하지 않을 수 있다는 힌트를 찾는 것으로 작업을 시작했습니다. 이런 경우가 있는 것 같았습니다. HD 환자의 뇌에는 성상교세포의 변화가 있지만 HD의 진행에 중요한가요, 아니면 다른 세포 유형의 변화를 반영하는 것일 뿐입니까?
“징크 핑거"라고 불리는 매우 멋진 헌팅틴 저하 도구는 돌연변이 헌팅틴 유전자의 발현을 차단할 수 있습니다. 이전에 Buzz에서 ZFP에 대해 쓴 적이 있습니다. 여기에서 읽을 수 있습니다: https://en.hdbuzz.net/275
UCLA 팀은 이러한 헌팅틴을 낮추는 페이로드를 뉴런이나 성상세포를 포함한 뇌의 다양한 세포 유형에 전달하는 바이러스를 개발할 수 있었습니다. 이를 통해 다양한 유형의 세포에서 Huntingtin 유전자를 낮출 수 있습니다. 이 새로운 바이러스는 표적 세포 유형에서만 헌팅틴 유전자 수준을 매우 훌륭하게 감소시키므로 팀은 특정 세포에서의 헌팅틴 발현과 생쥐의 HD 유사 증상 사이의 관계에 대해 특정 질문을 할 수 있습니다. 각 세포 유형에서 돌연변이 헌팅틴을 차단하면 해당 세포 유형에서 발견되는 많은 변화가 구출되었습니다. 돌연변이 헌팅틴이 뉴런에서 차단되었을 때(HD의 병든 세포 유형), 그들은 지지 세포인 성상교세포에서 개선을 보았습니다! 이상해! HD 뇌의 아픈 지지 세포와 아픈 뉴런 사이에 일종의 피드백 루프가 발생하고 있음을 시사합니다. 또한 특정 세포 유형을 조작하는 힘을 보여줍니다. 상황이 항상 우리가 가정하는 것과 같지는 않습니다. 그런 다음 팀은 ZFP를 사용하여 헌팅틴이 성상교세포 또는 뉴런에서 낮아지면 HD 마우스의 HD 유사 증상에 어떤 일이 발생하는지 질문했습니다. 그들이 조사한 많은 증상은 뉴런에서 돌연변이 헌팅틴 유전자를 녹다운함으로써 개선되었지만 성상교세포에서 그것을 녹다운했을 때 덜 개선되었습니다.
이것은 중요합니다. Khakh는 성상교세포를 사랑하고 그들이 HD 증상을 유발하는지 이해하고 싶었습니다. 그들은 아주 좋은 일련의 실험을 했고 성상교세포가 변화했음을 발견했지만 결과에 비추어 볼 때 뉴런의 변화는 여전히 가장 중요한 요소로 남아 있습니다.
헌팅틴 메시지 처리
다음으로 CBMSO(Center for Molecular Biology Severo Ochoa)의 Jose Lucas가 헌팅틴 메시지가 처리되는 방식과 이것이 HD 환자에서 어떻게 다른지에 대해 이야기할 것입니다.
유전자 메시지가 처리되는 과정을 스플라이싱이라고 합니다. 이 주제는 이 과정을 살펴본 몇 가지 이전 강연에서 자주 등장했으며, 접합은 헌팅틴의 독성 엑손1 단편을 생성하는 것으로 생각됩니다. 스플라이싱은 다양한 다른 질병에서 잘못되기 때문에 질병 사이의 이 과정의 유사성을 이해하면 HD에 대한 질문과 신경 세포 손실과 같은 환자에게서 볼 수 있는 증상에 답하는 데 도움이 될 수 있습니다. Lucas와 동료들은 HD에서 접합 과정의 변화에 의해 어떤 유전자가 영향을 받는지 조사했습니다. 유전자의 메시지가 잘못 연결되면 해당 메시지의 전체 단백질 제품이 덜 만들어지는 경우가 많습니다. Lucas 연구실의 과학자들은 RBFOX1이라는 유전자를 인위적으로 켜면 접합 실수를 수정하는 데 도움을 주어 HD 마우스 모델의 증상을 개선할 수 있음을 보여주었습니다. 이 아이디어가 HD 치료를 위한 새로운 의약품을 만드는 데 도움이 될 수 있을까요?
유전자 메시지는 또한 계속해서 반복되는 많은 문자 A로 구성된 유전자 코드 시퀀스에서 "꼬리"를 제거하도록 처리됩니다. HD 모델에서 많은 메시지가 꼬리를 필요 이상으로 길게 유지하여 단백질 제품으로 전환되는 방식에 영향을 미친다는 것이 밝혀졌습니다. 이 연구에서 발견된 가장 영향을 받는 단백질 중 하나는 과학자들로 하여금 HD를 가진 사람들이 티아민이라는 비타민을 덜 섭취한다는 사실을 알게 했습니다. 그들은 감소된 수치를 나타내는 척수액의 티아민 수치를 측정하여 이를 확인했습니다. 과학자들은 현재 임상에서 두 가지 다른 질문에 대한 답을 찾고 있습니다. 티아민 수치가 HD 진행에 대한 바이오마커로 사용될 수 있습니까? 티아민 치료가 HD 환자의 증상을 개선할 수 있습니까?
이것들은 Lucas 그룹이 보고 있는 일반적으로 사용 가능한 비타민이지만 결정적인 답변을 위해서는 엄격하게 통제된 임상 시험이 필요합니다. 이 가능한 치료가 HD를 가진 사람들에게 어떻게 작용할 수 있는지에 대한 업데이트가 곧 제공되기를 바랍니다.
헌팅틴 단백질 분해 조절
오늘 회담을 마무리하면서 버클리 캘리포니아 대학교 하워드 휴즈 의학 연구소의 마이클 라페 박사는 헌팅틴이 세포에서 어떻게 분해되고 HD 치료에 어떻게 사용될 수 있는지에 대한 그의 연구에 대해 논의할 것입니다. Rapé 연구실은 헌팅틴 단백질을 표적으로 삼는 데 사용할 수 있는 작은 분자를 찾고 있어 세포의 기계가 이를 분해하고 제거하도록 하며, 이를 단백질 분해라고 합니다.
세포에는 분해를 위해 다른 단백질에 태그를 지정하는 특정 단백질이 있습니다. 따라서 이 과정을 제어할 수 있다면 세포가 분해하는 단백질을 제어할 수 있습니다. 이것은 해로운 단백질을 줄이거나 제거하려는 HD와 같은 질병에 매우 좋습니다! 뇌 질환 치료제의 한 가지 문제는 혈액-뇌 장벽(혈액 내 유해 물질로부터 뇌를 보호하는 선택적 장벽)을 넘어서는 것입니다. Rapé 연구소가 개발하고 있는 약물은 ASO(Roche 및 Wave가 개발한 약물과 같은)에 비해 작지만 여전히 대부분의 약물 분자에 비해 큽니다.
운 좋게도 과학자들은 소분자 분해제가 혈류에서 뇌로 전달될 수 있음을 보여주었습니다. 이는 HD와 같은 질병을 치료하기 위해 분해제를 만들려는 연구자에게 좋은 소식입니다.
우리 세포는 E3 리가아제라고 하는 다양한 단백질을 만들어 세포의 "쓰레기 태그"를 지정하고 분해 대상을 지정하는 데 사용됩니다. 헌팅틴 단백질에 태그를 지정하는 E3를 찾을 수 있다면 이를 이용하여 분해자 분자를 개발할 수 있습니다. Rape 연구실은 좋은 표적이 될 E3 리가제를 식별할 수 있는 화면을 개발했습니다. 그들은 RNF126을 활용하여 헌팅틴 분해자 분자의 발달에 필요한 모든 특성을 갖고 있는 것으로 보이는 RNF126이라는 E3 리가제를 확인했습니다. 다음으로 그들은 RNF126이 헌팅틴 단백질을 특이적으로 분해할 수 있는지 테스트했습니다. 그들은 RNF126의 발현이 증가하면 세포에서 유해한 헌팅틴이 분해된다는 것을 발견했습니다!
그러나 이러한 실험은 유해하고 확장된 헌팅틴의 단편으로 수행되었습니다. 확장된 CAG 반복이 있는 전장 헌팅틴 단백질로 동일한 실험을 수행하면 어떻게 됩니까? 결과가 복제되었습니다! 함께 이러한 데이터는 건초 더미에서 이 바늘을 찾을 수 있었음을 시사합니다. 헌팅틴에 결합하여 질병을 유발하는 단백질 응집을 방지하기 위해 세포에서 자연적으로 분해되도록 하는 완벽한 효소입니다.
다음 단계는 RNF126이 헌팅틴 단백질 분해를 돕도록 하는 분자 접착제라고 불리는 화합물을 식별하기 위해 약물 개발에서 RNF126을 발전시키는 것입니다. 우리는 이 흥미진진한 분자에 대한 다음 단계가 무엇인지 애타게 기다리고 있을 것입니다!
더 많은 업데이트를 기대해주세요!
오늘은 여기까지입니다. 우리는 밤에 쉬고 있지만 HD 치료에 대한 혁신적인 접근 방식에 초점을 맞춘 연구 업데이트를 계속하기 위해 내일 아침에 다시 돌아올 것입니다!


